Estas prácticas las diseñé para y realicé con 5 grupos de 2º de la ESO en el marco del programa Comenius de la UE, siendo profesor de Ciencias de la Naturaleza en el IES Teguise:
Presento la memoria a continuación.
1 CONFERENCIA SOBRE ENERGÍAS RENOVABLES Y DEMOSTRACIÓN PRÁCTICA
Barry Sargeant es un ingeniero eléctrico (Hatfield University, U.K.) de 65 años, con 12 años de experiencia en ingeniería general, 16 en docencia de ciencias y politecnia, y más de 20 años dedicado al diseño y construcción de unos 100 proyectos de ingeniería solar, eólica y combinada, automatizando labores cotidianas y agrícolas en casas y granjas de Lanzarote. Todo ello compaginado con su pasión por el saxo, al que también se ha dedicado profesionalmente.
Extracto de su artículo El planeta paga la energía desperdiciada, publicado en abril de 2007 en la revista Lanzarote Gazette:
[…] No es difícil entender por qué la gente encuentra tan atractivas las energías solar y eólica aquí en Lanzarote −siendo tan soleada y ventosa−, pero los motivos por los que se decide elegir sistemas de Energías Renovables a menudo tienen menos que ver con ser “verde” y más con aspectos prácticos y económicos. Las alternativas son generalmente menos apetecibles:
1.- Emplear ruidosos generadores para proveer tu casa con constantes partidas de combustible, que además de sufrir averías y precisar abundante mantenimiento, son extremadamente ineficaces.
2.- En zonas rústicas contratar un cable subterráneo desde el punto de conexión más cercano es a la vez muy costoso económicamente y a la hora de obtener el permiso (2 años).
A pesar de todo los sistemas solares siguen costando 6.000-12.000 € por vivienda, dependiendo de la cantidad de electricidad requerida […] Use bombillas de baja energía y electrodomésticos de clase A […]
Fotografías mostradas en la conferencia a la que asistió el alumnado:
Paneles solares o placas fotovoltaicas. Celdas: Conexión en serie y paralelo, sube la Intensidad y el Voltaje.
Molino familiar de veleta (Detalle del eje) y molino industrial.
Termo solar, calefacción solar y piscina climatizada solar.
Parque eólico y central fotovoltaica.
Baterías, instalación y cuadro de mandos. Bicicleta eléctrica. Detalle de la dínamo.
2 JABÓN DE MARSELLA
Reacción general ácido-base:
ÁCIDO + BASE => SAL + AGUA
Reacción de saponificación:
ÁCIDO GRASO + HIDRÓXIDO => JABÓN + AGUA
Jabón de Marsella:
Ácidos grasos vegetales + Hidróxido de sodio => Oleato sódico + Agua
ACEITE DE OLIVA + SOSA CÁUSTICA => JABÓN DE MARSELLA + AGUA
1.- Pesar 10 g de NaOH.
2.- Disolverlos en 50 ml de agua. La temperatura se eleva, es una reacción exotérmica (cede energía térmica, se desprende calor). Si salpica es corrosiva, se neutraliza con vinagre o ácido acético. No use utensilios de aluminio.
3.- Ir añadiendo poco a poco aceite (50 ml) removiendo enérgicamente durante 20-30 minutos, hasta que la mezcla sea homogénea. Al final de este paso se le pueden añadir colorantes.
4.- Llenar los vasitos de chupito. En este paso se le pueden añadir aromas.
5.- Dejar cuajar durante unos días (3-5).
3 FUEGOS ARTIFICIALES
Mezcle 12 g de S con 15 g de KNO3 y con 21 g de carbón vegetal (que debe machacar previamente con mortero. El carbón de barbacoa es perfecto). Que la mezcla quede homogénea. Haga 5 montoncitos diferentes. Colocar cada uno en un recipiente de vidrio (Tarro de cristal de cualquier alimento). El primer tarro déjelo intacto, al segundo añádale NaCl (Sal común), al tercero CuSO4, (NH4)2SO4 y KClO3, al cuarto KClO3 y H3BO3, y al quinto NaNO3, SrSO4 y NaCO3. Se pueden añadir unas gotas de acetona sobre cada mezcla. Asir a un palito de madera un cachito de cinta de magnesio enganchado como una bandera en un extremo. Prender el magnesio con un mechero. Acercar la mecha de magnesio a la mezcla (Tarda un poco en prender) y cuando haya prendido remover un rato la mezcla aprovechando el palito. Alejarse 2-3 metros. Los tarritos terminan por romperse así que conviene colocarlos encima de un periódico.
¿Qué ocurre con el magnesio al prenderlo con el mechero?
¿Cómo se ve cada pólvora?
4 ESPEJO DE PLATA
GRUPO 1: Disolver 7 gramos de KOH en 50 cc de agua y dejar enfriar.
GRUPO 2: Disolver 1 gramo de AgNO3 en 25 cc de agua.
GRUPO 3: Disolver 10 gramos de AgNO3 en 50 cc de agua.*
GRUPO 4: Añadir gota a gota y agitando amoniaco concentrado a la disolución del grupo 3. Se enturbiará y luego irá aclarándose. Añadir hasta que se aclare completamente.
GRUPO 3/2: Añadir gota a gota la disolución del grupo 2 a la del grupo 3 hasta que se enturbie ligeramente.
GRUPO 1: Añadir lentamente y agitando la disolución del grupo 1 a la del grupo 3.
GRUPO 4: Añadir gota a gota y agitando amoniaco concentrado hasta que prácticamente se aclare.
GRUPO 2: Añadir gota a gota, lentamente y agitando la disolución del grupo 2 hasta que se enturbie ligeramente y se forme un precipitado marrón o negro.
GRUPO 5: Preparar el filtro y el embudo. Filtrar y completar hasta 250 cc. No dejar que se seque ni que le dé la luz.
GRUPO 5: Disolver 4 gramos de glucosa en 50 cc. Completar hasta 125 cc.
Mezclar ambas disoluciones (la del grupo 3 y la del grupo 5). Esperar 10 minutos, vaciar el líquido y dejar reposar con agua durante media hora.
5 BOMBA
Introducir bolitas de papel de aluminio en una botella de plástico. Con un embudo añadir ácido clorhídrico (HCl) y cerrarla rápidamente. El hidrógeno (H) del ácido se liberará en forma de hidrógeno gas (H2), en gran cantidad porque cada átomo de aluminio capta 3 átomos de cloro (Cl) dejando 3 átomos de hidrógeno libres.
La reacción es la siguiente:
6HCl + 2Al => 2AlCl3 + 3H2
6 CLAVES DICOTÓMICAS DE ROCAS MAGMÁTICAS-METAMÓRFICAS
1.- Con cristales visibles..........2
Sin cristales visibles..........8
2.- Parecida al vidrio, de color negro, con cortes concoides => OBSIDIANA
No se parece al vidrio..........3
3.- Color negro o muy oscuro, sin cuarzo, con algunos cristales de feldespato y mica negra => GABRO
Al menos parte de la roca es de color claro..........4
4.- Con cristales a modo de láminas o bandas..........5
Con cristales salteados y a modo de gránulos..........7
5.- Color anaranjado, con cristales grandes de cuarzo, feldespato y mica => PEGMATITA
No es de color anaranjado..........6
6.- Con cristales en capas muy apretadas o compactas. Exfolia en láminas (Mucha mica blanca) => ESQUISTO
Con cristales en bandas alternas claras y oscuras, deformadas y onduladas. Con mucho cuarzo (gris) y feldespato (blanco) => GNEIS
7.- Sin cuarzo o con muy poco, con feldespato rosado (Ortosa) y micas => SIENITA
Con 3 tipos de minerales: cuarzo (gris), feldespato (blanco o rosado) y mica (blanca, negra o ambas) => GRANITO
8.- Con cavidades, porosa, muy ligera y de color claro. De aspecto esponjoso, puede flotar en el agua => PUMITA
No puede flotar en el agua..........9
9.- Aspecto liso, color predominantemente negro, forma láminas planas => PIZARRA
No forma láminas..........10
10.- Aspecto fluido y rugoso, suele tener burbujas => ESCORIA VOLCÁNICA
Aspecto compacto..........11
11.- Alta densidad, color oscuro (negro), con algunos minerales encerrados. A veces con cristales verdes (Olivino) y con alguna cavidad => BASALTO
Colores normalmente claros, nunca negro*..........12
12.- Aspecto de cerámica, color pardo rojizo. Al golpear dos de ellas provocan un sonido metálico agudo => FONOLITA
Sin las características anteriores..........13
13.- Color gris claro (blancuzco o rosado si está muy degradada). A menudo con poros y salpicaduras de cristales blancos => TRAQUITA
Sin las características anteriores..........14
14.- Efervescente al añadir un ácido. Aspecto de terrón de azúcar, color normalmente claro, dureza media (Se raya con navaja). A menudo con vetas de otro color => MÁRMOL
Muy dura, no se raya con navaja. No se distinguen diferentes minerales. Color claro => CUARCITA
* Excepto el mármol negro, que burbujea al añadir un ácido (HCl).
MINERALES
La mayoría de las rocas magmáticas y metamórficas están compuestas por 3 minerales, que son los más abundantes de la corteza terrestre:
1.- FELDESPATO:
SILICATOS de Al con otros metales: Ca, Na y/o K.
O
|
O ~ Si ~ O
|
O
=> Molécula cargada negativamente cuando hay mucha humedad y CO2 (Dióxido de carbono), que se transforma en carbonato en una reacción química (meteorización). Si los carbonatos son de Ca se forma CALCITA. El feldespato es un mineral duro, de color blanco o muy claro, que sobretodo forma parte de las rocas magmáticas o ígneas.
(*) ORTOSA: Tipo de feldespato normalmente de color rosa carne. Aparece sobretodo en rocas magmáticas plutónicas o plutonianas, responsables de la formación de cordilleras (granito, gneis, pegmatita).
2.- CUARZO:
SÍLICE (Dióxido de silicio).
O = Si = O
=> No reacciona pero suele contener impurezas (Si resultan en color violeta se llama AMATISTA, en amarillo CITRINO). Si es puro es transparente (grisáceo), no se exfolia en láminas y es tan duro que puede rayar los aceros comunes. Aparece sobretodo en las rocas magmáticas plutónicas que forman la base de los continentes (especialmente granito). Al ser el último mineral en cristalizar (cristalización lenta) se adapta a la forma de los otros minerales que constituyen las rocas. Resiste muy bien la meteorización y la erosión. Cuando cristaliza en una cavidad se llama GEODA.
3.- MICA:
Mineral con una laminación muy evidente. Es muy maleable y las láminas son finas y brillantes. Forma parte de rocas magmáticas (granito, pegmatita, sienita, gabro…) y metamórficas (esquisto…). Hay 2 tipos, micas BLANCAS y micas NEGRAS.
- Conociendo las características de los 3 minerales es lógico que:
1º los feldespatos y las micas se convierten antes en ARCILLAS y se dispersan (meteorización/erosión).
2º el cuarzo da lugar a granos de ARENA (prácticamente solo erosión).
- Los diagramas relativos al silicato y al sílice son interpretaciones en 2D de las moléculas reales en 3D. Las rayas representan enlaces químicos (La estructura del sílice es más fuerte porque los enlaces son dobles y más estable porque no quedan electrones libres para enlazar con otros átomos).
- Elementos químicos: Al: Aluminio, Ca: Calcio, Na: Sodio, K: potasio, Si: Silicio, O: Oxígeno, C: Carbono.
7 EXTRACCIÓN Y SEPARACIÓN DE PIGMENTOS VEGETALES
CLOROFILA: La clorofila a es la más abundante de la naturaleza (75% del total). Su fórmula es C55H72N4O5Mg. En 1 kg de hojas hay aproximadamente 2 g de clorofila. La clorofila a aparece en todos los seres fotosintéticos excepto algunas bacterias, la b principalmente en algas verdes y plantas, y las c, d y e en algunos protoctistas.
· Las clorofilas captan la luz solar pero reciben ayuda de otros pigmentos, los carotenoides. Hay 2 tipos: CAROTENOS y XANTOFILAS. Los carotenoides no son de color verde.
BENCENO: ¿Cómo se ha visto a lo largo de la historia?
Kekulé (1865). Actualidad.
· El benceno no suele reaccionar aunque es inflamable. El anillo es muy estable porque en realidad no hay enlaces simples y dobles alternos (Resonancia) sino que los 18 electrones compartidos fluyen por los 6 carbonos (C).
POLARIDAD: Un compuesto o molécula es polar cuando la resultante de sus cargas no es 0, es decir, las fuerzas eléctricas que se generan no se anulan entre sí. Las clorofilas y los carotenoides son muy apolares. El benceno es completamente apolar.
+ POLAR <--- ---> + APOLAR
(- APOLAR) (- POLAR)
Clorofila b > Xantofilas > Clorofila a > Carotenos
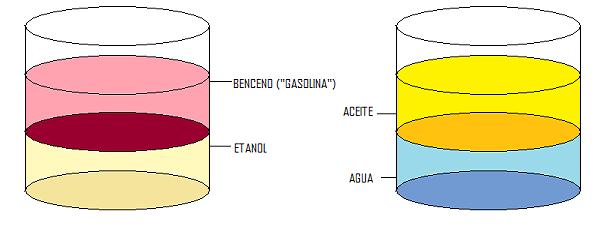
· El alcohol es polar y el benceno apolar, igual que el agua es polar y el aceite apolar. Las sustancias polares se disuelven en otras sustancias polares (Por ejemplo el alcohol es muy soluble en agua) y las sustancias apolares se disuelven en otras sustancias apolares (Por ejemplo las clorofilas y los carotenoides son solubles en benceno).
PROCEDIMIENTO:
Extracción:
1.- Machacar en un mortero hojas de espinaca (muy ricas en clorofila) con un poco de etanol (alcohol).
2.- Filtrar.
3.- Verter sobre un vaso con etanol y benceno.
4.- Agitar, esperar y extraer la fase superior.
Separación:
5.- Verter sobre un vaso con etanol y colocar un papel de filtro (CROMATOGRAFÍA).
Dibuje el resultado identificando los diferentes pigmentos.
8 DETERMINACIÓN DE ALMIDÓN
El almidón se tiñe de color azul cuando reacciona con el yodo (LUGOL). Es una forma sencilla de detectar almidón en las estructuras de reserva energética de las plantas, como los tubérculos (papa, ñame, boniato…).
Cortar una papa de ciclo corto y otra de ciclo largo en pedazos. Añadir la disolución de Lugol y comparar los resultados, utilizando almidón puro (concentrado) como control positivo de la prueba.
9 ECOSISTEMAS (TERRESTRES)
Animales terrestres: Buscar −mediante el banco de biodiversidad− tipo y nombre de los especímenes encontrados por el alumnado, con la ayuda del profesor (Llevándolo hasta familia en los grupos más amplios como Scarabaeidae, o hasta orden o clase en los menos, como Odonata o Amphibia respectivamente) y apoyándose en las imágenes de internet (El profesor debe asesorarlo). En general se le pide que traiga invertebrados, a poder ser muertos antes del rastreo, y concretamente artrópodos, por su interés especial en el temario (Diría Edison algo así como que son pura energía) y por ser lo más manejable.
Suelos: Con muestras previamente tomadas por el alumnado se determinan los tipos de suelo más comunes de la zona (Los principales son en el municipio de Teguise y otras zonas de Lanzarote el picón y similares, la arena, la arcilla, mixtos, jable, caliche y mantillo artificial).
Vegetales: Los más interesantes recogidos por el alumnado se seleccionan y se le explican sus peculiaridades (tipos de hoja, reservas de la planta y adaptaciones a la aridez, flores, frutos y esporas, raíz-tallo-hoja-flor-fruto…) para introducir conceptos básicos de botánica: Hojas simples, hojas compuestas (folíolos) con Nervios paralelos, nervios ramificados, Crasuláceas y similares (Kleinia, Aeonium, cactus…), Orquídeas, Helechos (Pteridium aquilinum = Uña de águila), Definiciones básicas enlazando una con otra: Raíz-Tallo-Hoja (Flor->Fruto)…
10 BIODIVERSIDAD DE CANARIAS
Presentar la base de datos explicando sus características y mirando algunos grupos taxonómicos importantes (Arachnida / Insecta - Arthropoda, Chordata, Spermatophyta, Fungi…). Localizar seres vivos que están en Lanzarote (o en otras islas) buscando con internet el nombre científico a partir del vulgar. Mostrar ejemplos significativos.
Ejemplo tipo:
Un depredador intrépido y audaz, en miniatura. El sarantontón (Coccinella algerica, vive en Canarias) parece una mariquita (Coccinella septempunctata, en Europa) pero no es la misma especie.
Sobre esta página:
RESPUESTA GENERAL
CALIDAD TOTAL
CSS3
FUNCIONAMIENTO
HTML5